
1. 사안의 개요
(1) 등재특허 존속기간 만료일: 2018. 11. 7.
(2) 제네릭 제품의 출하일시 및 배송처 도달일시 – 존속기간 만료 전일 또는 당일 출하함
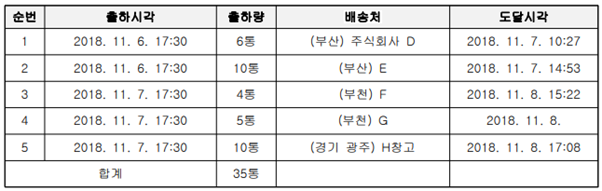
(3) 식약처 2020. 7. 14. 품목허가 취소 제재처분 - 처분 사유 “등재특허권의 존속기간이 만료된 후에 판매하기 위해 허가받은 이 사건 의약품을 등재특허권의 존속기간이 만료되기 이전에 판매한 사실이 있음”
2. 대상 제약회사의 주장요지
이 사건 등재특허권의 기간만료일인 2018. 11. 7. 하루 전날 혹은 당일 이 사건 의약품을 출하 하였는데, 이는 위 근거규정에서 품목허가 취소사유로 정하고 있는 ’판매‘가 아니라 ’판매를 위한 예비 내지 준비행위‘에 불과하다.
3. 서울행정법원 판결요지
[별표8] ’행정처분의 기준‘ II. 개별기준‘ 제36의2호 가목 - 약사법 제50조의4 제1항 제2호를 위반하여 등재특허권의 존속기간이 만료된 후에 판매하기 위해 품목허가 또는 변경허가를 신청한 자가 해당 기간이 만료되기 전에 의약품을 판매한 경우‘에는 1차 위반시 바로 해당 품목허가를 취소할 수 있도록 정하고 있고, 위 위반행위에 대해서는 품목허가 취소 외에 다른 제재처분을 정하고 있지 않다.
약사법에서는 ’약국개설자의 소비자들에 대한 소매행위‘와 ’의약품의 품목허가를 받은 제조업자 등의 약국개설자, 의약품 도매상 등에 대한 판매행위‘를 모두 ’판매‘로 규정하고 있다. 따라서 의약품 제조업자의 시중약국 또는 도매상에 대한 의약품 판매행위는 ’판매를 위한 예비 또는 준비행위‘가 아니라 ’판매‘ 자체에 해당한다.
이 사건 근거규정은 등재특허권자의 특허권을 침해할 위험이 있는 판매행위에 대해 제재를 가하고자 하는 목적에서 마련된 것인바, 비록 이 사건 출하행위 자체는 이 사건 등재특허권의 존속기간 만료일 전일 혹은 당일에 이루어졌으나, 판매행위를 이루는 일련의 주문, 생산 과정은 만료일보다 전에 이루어졌을 것인 점, 이 사건 등재특허권의 존속기간 중에 이 사건 의약품에 대한 주문이 이루어짐으로써 이 사건 등재특허권에 따른 의약품에 대한 수요가 감소되어 특허권자에게 대한 손해가 발생되었을 가능성이 있는 점 등에 비추어 보면, 이 사건 출하행위를 판매행위로 보아 이를 규제할 필요성도 충분히 인정된다.
등재특허권의 존속기간 만료 전에 주문, 생산, 출하가 모두 이루어지는 경우에도 이 사건 근거규정에서 정한 ’판매‘에 해당하지 않는다고 본다면, 등재특허권의 존속기간이 만료되지 않았음에도 제조업자가 관련 의약품을 제조․판매하여 이익을 얻고 등재특허권자에게 손해가 발생하더라도 이에 대한 행정적 제재를 가할 수 없는 문제가 발생된다. 이러한 해석은 이 사건 근거규정의 취지를 몰각시키는 것이어서 받아들일 수 없다.
첨부: 서울행정법원 2021. 7. 8. 선고 2020구합69236 판결
[질문 또는 상담신청 입력하기]


